top of page


PHYSIQUE CHIMIE AU LYCEE CHRESTIEN DE TROYES
LES SOLIDES IONIQUES
Un solide ionique est un solide composés d'ions. Etant donné qu'un tel solide est toujours électriquement neutre il associe toujours des cations et des anions dont les charges se compensent.


cristal de chlorure de sodium (sel de cuisine)
Comment expliquer la cohésion d'un cristal ionique?
Il s'exerce une force électrique répulsive entre les ions de même signe (anion/anion et cation/cation)et attractive entre les ions de charge opposée (anion/cation).
La cohésion d'un cristal ionique s'explique par une force électrique attractive entre les cations et les anions. (calculée grâce à la force de coulomb)
LES SOLIDES MOLECULAIRES
Ici, il faut que l'on s'attarde sur les liaisons covalentes et la géométrie des molécules.
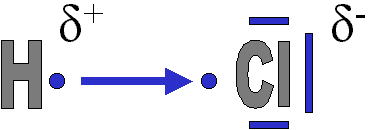
Certains atomes ont une capacité à attirer vers eux les électrons d'une liaison covalente: c'est l'électronégativité.

La liaison est dite polarisée.
Ici l'atome de chlore (Cl) est plus électronégatif, il attire plus vers lui les électrons de la liaison covalente qu'il forme avec l'atome d'hydrogène (H).
Par conséquent, l'atome de chlore obtient une charge partielle négative et l'atome d'hydrogène possède une charge partielle positive.

Quand est-ce qu'une molécule est polaire?
Avoir une ou plusieurs liaisons polarisées ne suffit pas...
Une molécule est polaire si le barycentre des charges positives ne coïncide pas avec celui des charges négatives.

Prenons un exemple: l'eau!

Les charges partielles négatives sont centrées sur l'atome d'oxygène (électronégatif): c'est le barycentre des charges négatives.
Les charges positives sont centrées sur un point au milieu des charges partielles positives: c'est le barycentre des charges positives.
L'eau est une molécule polaire car le barycentre des charges positives et négatives ne se superposent pas.
Un contre-exemple: le dioxyde de carbone
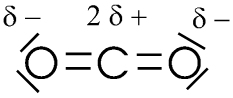

L'atome d'oxygène est plus électronégatif que l'atome de carbone.
Toutes les charges partielles positives sont centrées sur l'atome de carbone: c'est le barycentre "G + " des charges positives.
De part et d'autre, 2 charges partielles négatives portées par les atomes d'oxygène. Le barycentre "G -" de ces charges ( ou centre géométrique) est pile sur l'atome de carbone.
Les barycentres des charges positives et négatives se superposent : la molécule de CO2 est apolaire.
Expérience!
Seules les molécules polaires sont déviées!


Comment expliquer la cohésion d'un solide moléculaire?
Un solide moléculaire est un assemblage compact et ordonnée de molécules.
La cohésion des solides moléculaires est assurée par deux types d’interactions moléculaires :
- L’interaction de Van Der Waals,
- Les liaisons hydrogène.
L'interaction deVan der Waals

Ce sont des interactions de type électrostatique entre deux dipôles. Cela peut avoir lieu entre molécules polaires (dipôles permanents) mais également apolaires (dipôles temporaires)


Liaisons hydrogène
Une liaison hydrogène se forme lorsqu’un atome d’hydrogène H, qui est lié à un atome A très électronégatif, interagit avec un atome B, également très électronégatif et porteur d’un ou plusieurs doublets non liants.
Les atomes A et B qui interviennent généralement sont : l’azote N, l’oxygène O, le fluor F et le chlore Cl.


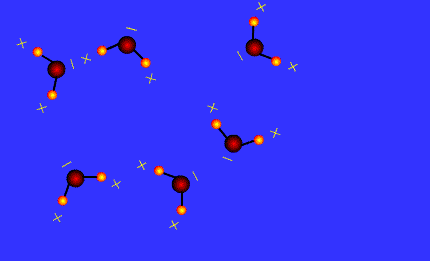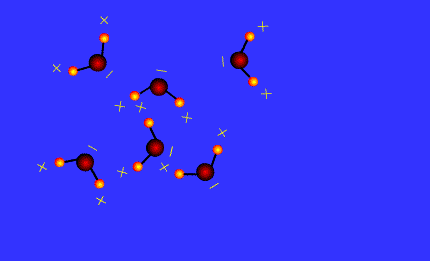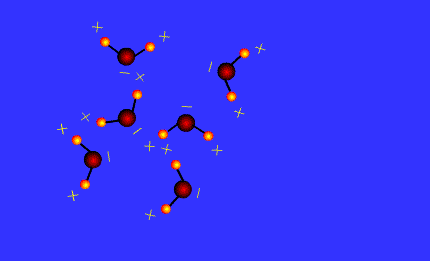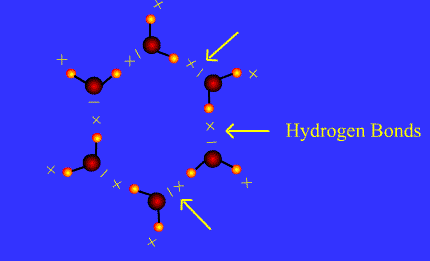
Les molécules qui possèdent le groupe – O – H forment des liaisons hydrogènes.
C’est le cas des alcools comme l’éthanol, de l’eau dans la glace.
Ces liaisons hydrogènes participent à la cohésion du cristal.
Dans ce cas, la cohésion du cristal est due aux liaisons hydrogène et aux interactions de Van Der Waals.
Pour faire fondre la glace, il faut suffisamment d'énergie pour rompre les forces de Van der Waals et les liaisons hydrogène.
BILAN
Solide ionique
force électrique entre les ions chargés (+ et -)
Solide moléculaire
Molécules polaires
Molécules apolaires
-force de Van der Waals
-liaison hydrogène
force de Van der Waals
INTERACTION PAR ORDRE DECROISSANT D'INTENSITE
force électrique entre les ions chargés (+ et -)
liaison hydrogène
force de Van der Waals
Que se passe-t-il lors d'un changement d'état?
La chaleur reçue par le solide est transformée en énergie cinétique : l’agitation thermique des molécules qui constituent le solide augmente. Quand cette agitation est suffisante, des interactions de Van Der Waals, qui assurent la cohésion du cristal sont rompues et l’édifice cristallin se disloque.
Les molécules restent en contact mais se séparent. Il n’y a plus de disposition régulière dans l’espace. C’est la fusion : on passe de l’état solide à l’état liquide.
Une fois toute l’espèce moléculaire à l’état liquide, l’agitation thermique augmente à nouveau et la température aussi. Au fur et à mesure que la température augmente, les interactions de Van Der Waals existant entre les molécules sont de moins en moins nombreuses, puis disparaissent totalement : c’est la vaporisation : on passe de l’état liquide à l’état gazeux.
Remarque : pour l’eau H2O, en plus des interactions de Van Der Waals, il faut rompre les liaisons hydrogène.
bottom of page